2022年3月30日更新
申請全般について
- Q1. 日本臨床内科医会の参加施設に限定しての審査になりますでしょうか?
他の参加施設でも同様に倫理審査をする必要があるという前提での審査でしょうか? - ・特定臨床研究の場合(CRBでの審査の場合)
参加する全ての実施医療機関について、一括して1つのCRBで審査をする必要があります。
参加する実施医療機関が当会の会員か非会員かは問いません。
・非特定臨床研究、観察研究の場合(IRBでの審査の場合)
原則として、参加する全ての研究機関について、一括して1つのIRBで審査をする必要があります。
参加する研究機関が当会の会員か非会員かは問いません。
ただし、自施設にIRBがある場合、個別の施設のIRBで審査を行うことも可とされています。
- Q2. 自施設にIRBが無い場合に日本臨床内科医会のIRBが審査をしてくれるという理解でよいでしょうか?
- ・非特定臨床研究、観察研究の場合(IRBでの審査の場合)
原則として、参加する全ての研究機関について、一括して1つのIRBで審査をする必要があります。
参加する研究機関が当会の会員か非会員かは問いません。
ただし、自施設にIRBがある場合、個別の施設のIRBで審査を行うことも可とされています。
- Q3. 審査が必要なのは、データ提供に関わる研究者だけでしょうか?
- ・特定臨床研究の場合(CRBでの審査の場合)
研究責任医師、研究分担医師に加えて、統計解析責任者および当該研究を実施することで利益を得ることが明白な者も、研究計画書および同意説明文書に明記し、また利益相反の自己申告および施設での事実確認をしていただく必要があります。
・非特定臨床研究、観察研究の場合(IRBでの審査の場合)
研究の実施に関わる、研究責任者、研究分担者に加えて、研究の技術的補助や事務に従事する職員も「研究者等」に含まれます。
ただし、既存試料・情報の提供のみを行い、研究の実施やインフォームド・コンセントを実施しない機関は、共同研究機関ではなく、「研究協力機関」となることも可能です。その場合、当該機関での倫理審査は不要ですが、試料・情報の提供に関する記録を作成・保管するなどの責務がありますのでご注意ください。
- Q4. 特定臨床研究か、非特定臨床研究、観察研究かは、どのように判断すれば良いでしょうか。
- 下記臨床研究の区分および適用法規を示したフローチャートをご参照ください。
有効性や安全性を明らかにするために医薬品や医療機器を人に対して用いる行為、すなわち「介入」を行う研究は、原則臨床研究法の対象となり、CRBでの審査となります。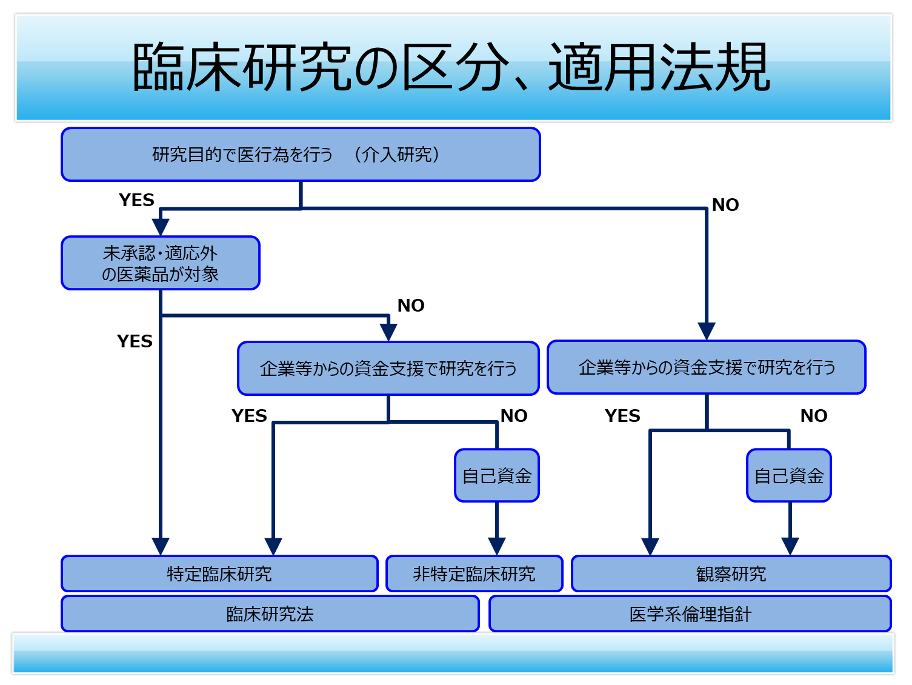
医薬品または医療機器による「介入」を行う研究の内、未承認・適応外の医薬品や医療機器を使う研究の場合、もしくは対象となる医薬品や医療機器のメーカーから研究資金の提供を受ける研究の場合は「特定臨床研究」に該当し、臨床研究法の遵守義務が発生するため、CRBでの審査が必須となります。
「介入」を行う研究でも、承認の範囲内であり、メーカーから研究資金の提供を受けない場合は、臨床研究法における「臨床研究」に該当し、臨床研究法が遵守努力義務となるため、必ずしもCRBでの審査ではなく、IRBで審査をすることも可となります。
「介入」を行わない研究、いわゆる「観察研究」は、臨床研究法の対象外となるため、人を対象とした生命科学・医学系研究に関する倫理指針の対象となり、IRBで審査をすることとなります。
観察研究には、前向き観察研究と後ろ向き観察研究がありますが、観察研究であれば前向きであっても後ろ向きであってもIRBでの審査対象です。
- Q5. 迅速審査をする場合の基準は何かで決まっているのですか?
- ・特定臨床研究の場合(CRBでの審査の場合)
臨床研究の実施に重要な影響を与えないものである場合であって、委員会の指示に従って対応するものである場合は、審査委員長の判断により、迅速審査とすることがあります。
また、以下の各号に掲げる事項については、「事前確認不要事項」として、事務局にて当該各号に該当することを確認の上、届出を受理し、収受印を押印した上で、その写しを交付することで、委員会の承認があったものとみなします。
① 研究に関する問い合わせ先の担当者および連絡先の変更(担当者の所属機関変更を伴わないものに限る)
② 実施医療機関の管理者およびその許可の有無の変更、臨床研究従事者の職名変更
③ データマネジメント担当機関、モニタリング担当機関、監査担当機関、研究・開発計画支援担当機関および調整・管理実務担当機関の担当責任者または担当者ならびにそれらの所属機関および役職の変更
④ 統計解析担当責任者の所属機関および役職の変更
⑤ 第一症例登録日の追加
⑥ 進捗状況の変更
⑦ 契約締結日の変更
⑧ e-Red 番号の変更
⑨ 委員会で承認を得る条件が明示的かつ具体的に指示されたうえで継続審査となった場合であって、当該指示の内容と異ならないことが明らかである変更
⑩ 研究内容の変更を伴わないことが明らかである誤記の修正または記載整備
・非特定臨床研究、観察研究の場合(IRBでの審査の場合)
以下に掲げる条件を満たしていると判断される場合、書面による迅速審査とすることがあります。
1. 当該研究機関が他の研究機関と共同で実施する研究であって、既に当該研究の全体について共同研究機関において倫理審査委員会の審査を受け、その実施について適当である旨の意見を得ている場合の審査
2. 研究計画書の軽微な変更に関する審査
3. 侵襲を伴わない研究であって介入を行わないものに関する審査
4. 軽微な侵襲を伴う 研究であって介入を行わないものに関する審査
ただし、迅速審査とするか否かは、申請を受け付けた後、申請書類を基に審査委員長が判断いたしますので、申請前には回答いたしかねます。ご了承ください。
- Q6. 申請後、どれくらいで審査結果通知書をいただけますか?
- 申請書類提出締切および審査会開催予定日は、当委員会ホームページの「開催日程」をご参照ください。
原則、締切日までにご申請いただいた案件は、対応する委員会で審査を行うことを想定しております。
ただし、書類不備などについての事務局からの指摘や、審査委員からの事前の疑義事項があり、申請者がそれらへの回答・修正した資料の提出に時間を要した場合、次回以降の審査会での審査とさせていただくことがございますので、ご了承ください。
また、Q5に記載の条件に該当し、書面による迅速審査とした場合には、申請後2週間以内を目安に、審査をいたします。
審査会での審査、迅速審査、いずれの場合でも基本的に、審査終了後、1週間~10日を目途に、審査結果通知書を発行いたします。
ただし、審査の結果、疑義事項が多数挙がった場合などは、審査結果通知書の発行にもう少々お時間をいただくことがございますので、ご了承ください。
研究計画書について
- Q7. 研究計画書に記載が必要な事項は何ですか?
- 特定臨床研究においては、臨床研究法、非特定臨床研究、観察研究においては、人を対象とする生命科学・医学系研究に関する倫理指針に、それぞれ研究計画書に記載が必要な事項が列挙されていますので、それぞれの規定を確認の上、記載が必要な事項が網羅された研究計画書を作成ください。
なお、当委員会では、研究計画書に記載が必要な事項のチェックリストをホームページに掲載しておりますので、必要に応じてご活用ください。(当該チェックリストは申請時のご提出は不要です)
- Q8. 症例報告は患者の同意があれば倫理審査申請は不要でしょうか。
- 1~2例の特異な症例について報告する「症例報告」であれば、研究には該当せず、倫理審査の申請は不要です。患者さんの同意を得た上で、ご発表などいただければと存じます。
ただし、過去の診療情報を用いる場合であっても、数例以上の患者さんの情報を収集して解析される場合には、「後ろ向き観察研究」に該当し、倫理審査が必要になりますので、ご注意ください。
同意説明文書について
- Q9. 同意説明文書に記載が必要な事項は何ですか?
- 特定臨床研究においては、臨床研究法、非特定臨床研究、観察研究においては、人を対象とする生命科学・医学系研究に関する倫理指針に、それぞれ同意説明文書に記載が必要な事項が列挙されていますので、それぞれの規定を確認の上、記載が必要な事項が網羅された同意説明文書を作成ください。
なお、当委員会では、同意説明文書に記載が必要な事項のチェックリストをホームページに掲載しておりますので、必要に応じてご活用ください。(当該チェックリストは申請時のご提出は不要です)
- Q10. 同意撤回はいつでもできると説明文書に記載していますが、同意撤回書を別途作成した方がよいでしょうか?
- 同意撤回書も作成をお願いいたします。
利益相反申告について
- Q11. 利益相反申告書の申請は、研究責任者のみで良いでしょうか?
- ・特定臨床研究の場合(CRBでの審査の場合)
研究責任医師、研究分担医師に加えて、統計解析責任者および当該研究を実施することで利益を得ることが明白な者も、研究計画書および同意説明文書に明記し、また利益相反の自己申告および施設での事実確認をしていただく必要があります。
・非特定臨床研究、観察研究の場合(IRBでの審査の場合)
研究の実施に関わる、研究責任者、研究分担者に加えて、研究の技術的補助や事務に従事する職員も「研究者等」に含まれます。
ただし、既存試料・情報の提供のみを行い、研究の実施やインフォームド・コンセントを実施しない機関は、共同研究機関ではなく、「研究協力機関」となることも可能です。その場合、当該機関で既存試料・情報の提供のみに携わる方は、利益相反申告書の提出は不要です。
教育・研修の受講記録について
- Q12. 倫理講習受講証明書について、どの講習でもよろしいのでしょうか?
- 複数の講義が選べるe-learningの場合、どの講習を受ければ良いでしょうか。
受講証明書が発行される倫理講習でしたら、基本的にどこの講習でも構いません。
ただし、受講証明書の記載から、どのような講習なのか内容が分からない場合には、問い合わせをさせていただく場合がございますので、ご了承ください。
複数の講義が選べる場合には、極力臨床研究全般について学べる講座、特に特定臨床研究の申請にあたっては臨床研究法について、非特定臨床研究、観察研究の申請にあたっては人を対象とする生命科学・医学系研究に関する倫理指針についての講義を受講いただくことが望ましいと考えます。
なお、申請にあたっては、申請時より過去1年以内の受講証明書をご提出ください。
審査手数料について
- Q13. 研究代表者が貴会会員でなくても、共同研究者に貴会会員が入っていれば、会員価格になりますでしょうか。
- 研究代表者/研究代表医師が当会会員の場合に、会員価格を適用します。